خبير طبي في المقال
منشورات جديدة
الأدوية
العقاقير التي تمنع تجلط الدم وتحسن من انسيابية الدم
آخر مراجعة: 07.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
في الوقاية من تكوين الجلطات الدموية الدقيقة المتعددة أثناء الصدمة وتدميرها، يمكن استخدام العديد من الطرق الدوائية التي تستخدم الأدوية التي تمنع تكوين الجلطات وتحسن ريولوجيا الدم:
- إزالة اضطرابات الدورة الدموية الدقيقة والجهازية باستخدام العوامل الفعالة للأوعية الدموية والعوامل المؤثرة على التقلص العضلي؛
- إجراءات لتحسين ريولوجيا الدم باستخدام العلاج بالتسريب العقلاني والأدوية التي تعيد مرونة أغشية كريات الدم الحمراء (ترينتال أو بنتوكسيفيلين)؛
- منع تراكم الصفائح الدموية وتكوين الجلطات "البيضاء" الأولية في الأوعية الشريانية الصغيرة مع البدء اللاحق في عملية التخثر؛
- تثبيط تكوين الخثرة بعد تنشيط سلسلة التخثر الجهازية؛
- تنشيط انحلال الفيبرين بهدف إذابة جلطات الدم المتكونة حديثًا (فيبرينولايسين، ستربتوكيناز، ستربتوديكاس، يوروكيناز، إلخ) أو على العكس من ذلك، تثبيط انحلال الفيبرين عندما يكون معممًا في بعض المرضى المصابين بالصدمة الرضحية والإنتان (حمض أمينوكابرويك، أمبين، كونتريكال، إلخ).
معظم الطرق المذكورة تقليدية، ومتطورة في علاج الصدمات، ولها دواعيها الخاصة المتعلقة بتدفق الدم، وهي مُحددة في الفصول ذات الصلة. لذلك، يُنصح في هذا القسم بدراسة النهج العام للوقاية من تكوّن الجلطات في حالات الصدمة باستخدام عوامل دوائية تؤثر على الطور التمهيدي لتخثر الدم. هذا المستوى من الوقاية من مضاعفات التخثر - حدوث وتكوين ونمو "الجلطات الشريانية البيضاء" - هو ما يجذب أكبر اهتمام من الباحثين.
تُعدّ اضطرابات تخثر الدم، والتي غالبًا ما تكون متعددة الاتجاهات، مصحوبة بتدهور في ريولوجيا الدم، من السمات المميزة لأنواع مختلفة من الصدمات. ومن أبرز أنواع الصدمات الإنتانية، والصدمات الناتجة عن السموم الداخلية، والحروق، والصدمات، والنزفية، تكوّن جلطات دقيقة متعددة في أصغر الأوعية الدموية، نتيجة اضطرابات في ديناميكا الدم الجهازية، وتشنج الأوعية الدموية، واضطرابات الدورة الدموية الدقيقة، وزيادة كثافة الدم، والرواسب، وانخفاض مرونة أغشية كريات الدم الحمراء، بالإضافة إلى العديد من العوامل العامة والمحلية (العوامل الذاتية) التي تُحدث تغيرات موضعية في إرقاء التخثر، وبدء الطور التمهيدي لتخثر الدم.
في شكل تخطيطي (مختصر)، يتم تقديم المرحلة الأولية لتخثر الدم وآلية توازن تخثر الدم المحلي على النحو التالي.
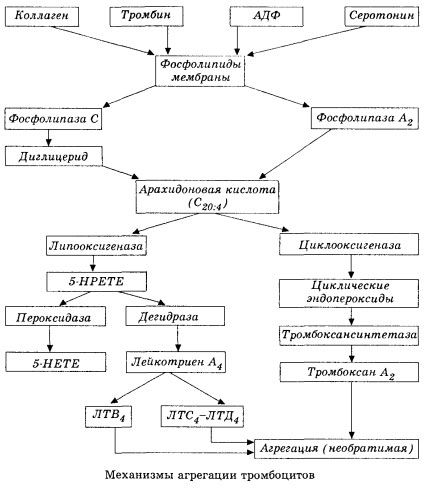
يبدأ بتنشيط فوسفوليباز الغشاء A2 نتيجةً لتأثير مجموعة من العوامل الضارة (تلف الغشاء المباشر، نقص الأكسجين، بيروكسيد الدهون، تأثير العوامل الكيميائية الداخلية، إلخ). نتيجةً لتحلل فوسفوليبيدات الغشاء، تُطلق أحماض دهنية طويلة السلسلة غير مُستَرّة، ويُعدّ حمض الأراكيدونيك أهمها كركيزة أولية. يحدث تحوله (سلسلة حمض الأراكيدونيك) عبر مسارات ليبوكسجيناز (تخليق الليكوترينات) وسيكلوأوكسجيناز (تخليق البروستاجلاندينات، الثرومبوكسانات، البروستاسيكلين).
تُعدّ الليكوترينات الناتجة (B4، C4، E4، D4، إلخ) - وهي مواد ذات نشاط بيولوجي عالٍ للغاية، وتشمل مادة الحساسية المفرطة بطيئة التفاعل - ذات أهمية بالغة في بدء التفاعلات الوعائية والالتهابية والمناعية الموضعية، بما في ذلك العمليات المناعية الذاتية. تُسبب الليكوترينات اضطرابات في الدورة الدموية الدقيقة، وزيادة تخثر الدم، وإطلاق إنزيمات الليزوزومات ذاتية التحلل، وإطلاق عامل في الدم يُثبط انقباض عضلة القلب وتشنج الشعب الهوائية.
بسبب قدرتها على التسبب في تقلص العضلات الملساء، تؤثر الليكوترينات بشكل كبير على ديناميكا الدم الجهازية والأوعية التاجية وعضلة القلب، وتمارس قابضًا تاجيًا قويًا وتأثيرًا سلبيًا تقلصيًا، والذي يصاحبه انخفاض في النتاج القلبي ويلعب دورًا مهمًا في تطور انخفاض ضغط الدم.
يرتبط انخفاض النتاج القلبي وانخفاض ضغط الدم الناتج عن الليكوترينات بضعف عضلة القلب وتقييد العودة الوريدية إلى القلب. ومن أهم العوامل التي تؤثر في الحد من العودة الوريدية قدرة الليكوترينات على زيادة نفاذية جدار الأوعية الدموية والتسبب في تسرب البلازما. وتُعتبر الليكوترينات عاملاً هاماً في التسبب في احتشاء عضلة القلب.
في حالات الصدمة التأقية والصدمة الإنتانية (الصدمة الداخلية)، يبدو أن دورها يزداد بشكل أكبر، كما يتضح من قدرة الليكوترينات على التراكم بكميات كبيرة في البلازما أثناء التفاعلات التحسسية، وإحداثها تغيرات في تدفق الدم الجهازي، وهي سمة مميزة للصدمة التأقية، بالإضافة إلى التأثيرات الوقائية لحاصرات مستقبلات الليكوترين ومثبطات الليبوكسيجيناز. يجري تطوير حاصرات مستقبلات الليكوترين الانتقائية بشكل مكثف، وهو اتجاه علمي واعد. وقد تحقق في هذا المجال بعض النجاح، وتم تأكيد فعالية هذه الحاصرات تجريبيًا في حالات نقص تروية عضلة القلب، والصدمة الداخلية، والصدمة النزفية. ومع ذلك، من المرجح أن يستغرق الأمر عدة سنوات أخرى قبل تطبيق هذا التوجه سريريًا.
إذا كانت الخثرات الدموية تتشكل في الأوعية الوريدية بمشاركة متساوية من الصفائح الدموية وعوامل تخثر البلازما، فإن الصفائح الدموية في الشرايين هي المحفز الرئيسي لهذه العملية. تحتوي هذه الصفائح على ADP، وCa2+، والسيروتونين، والفوسفوليبيدات، وإنزيمات تخليق البروستاجلاندين والثرمبوكسان، والثرمبوستينين (الذي يُوفر، مثل الأكتوميوسين العضلي، القدرة على الانقباض لهذه الخلايا)، وعامل النمو التخثري للظهارة وخلايا العضلات في جدار الأوعية الدموية، وعدد من المواد الأخرى. يتم التنظيم الخلطي لوظائف الصفائح الدموية من خلال مستقبلات متخصصة في أغشيتها (مستقبلات ألفا 2 وبيتا 2 الأدرينالية، ومستقبلات الهيستامين والسيروتونين، والأستيل كولين، والثرمبوكسان، والأدينوزين، وغيرها). من الخصائص الخاصة للصفائح الدموية هي تقاربها العالي مع الكولاجين والعناصر تحت البطانية الأخرى لجدار الأوعية الدموية، للأسطح غير المبللة والمشحونة سلبًا. توفر هذه الخاصية للصفائح الدموية قدرة استثنائية على الالتصاق (الالتصاق) بجزء من الوعاء الدموي به بطانة تالفة، والتي لديها فرصة كبيرة للتلف أثناء الصدمة. في هذه الحالة، تنتشر الصفائح الدموية وتطلق أقدامًا كاذبة، والتي يمكن أن تلتصق ببعضها البعض وبجدار الوعاء الدموي. تزداد نفاذية الغشاء، ويتم إطلاق ADP والسيروتونين والثرومبوكسان وبعض عوامل التخثر الممتصة على سطح الصفائح الدموية من الصفائح الدموية. تتفاعل هذه المواد مع المستقبلات المقابلة على الغشاء، وبمشاركة أيونات الكالسيوم، تسبب التكتل (قابل للعكس في البداية). تصبح العملية ذاتية الاستدامة، والتي يتم تسهيلها من خلال العوامل التنظيمية الخلطية؛ وعلى العكس من ذلك، يمكن لعوامل أخرى أن توقفه، بل وحتى تعكسه، مما يتسبب في التفكك.
مع غلبة التأثيرات والظروف المكونة للخثرة، يتم استبدال مرحلتي الالتصاق والتجمع القابل للعكس بالمرحلة الثالثة - التجمع غير القابل للعكس، والذي يتم تنفيذه بمشاركة الثرومبوستينين ويؤدي إلى تضييق الجلطة؛ يحدث تفاعل تقوية التكتل والتضييق أيضًا بمشاركة Ca +، ATP ويؤدي إلى تكوين خثرة بيضاء.
يضمن مسار تحويل حمض الأراكيدونيك بواسطة إنزيم السيكلوأكسجيناز في الصفائح الدموية والخلايا البطانية الوعائية والأنسجة الأخرى استتباب التخثر الموضعي (حيث يكون عمر النصف للمستقلبات قصيرًا جدًا)، حيث تتكون مواد قوية داعمة ومضادة للتكتل خلال هذا الاستقلاب. العامل الرئيسي الذي يُنشّط تكتل الصفائح الدموية في سلسلة تفاعلات السيكلوأكسجيناز هو الثرومبوكسان A2، ومضاده الذي لا يقل قوة هو البروستاسيكلين، الذي تنتجه الخلايا البطانية، وبدرجة أقل، البروستاجلاندينات من السلسلتين E وG. وأخيرًا، يتأثر تكتل الصفائح الدموية بشدة بعوامل خلطية موضعية وجهازية إضافية.
منشطات ومثبطات تراكم الصفائح الدموية
المبادرون والمنشطون لتجمع الصفائح الدموية |
مثبطات تراكم الصفائح الدموية |
الكولاجين |
- |
ADP |
الأدينوزين ومثبتاته |
النورإبينفرين (عبر مستقبلات ألفا 2) |
عوامل حجب ألفا الأدرينالية |
السيروتونين |
عوامل مضادة للسيروتونين |
الهيستامين |
مضادات الهيستامين |
الثرومبين |
الهيبارين |
Ca2+ |
مضادات Ca2+ |
CGMP - محفزاته (أستيل كولين؟) ومثبتاته |
CAM - محفزاتها (عبر مستقبلات بيتا الأدرينالية) ومثبتاتها (مثبطات فوسفوديستيراز) |
حمض الأراكيدونيك |
دكستروز، ألبومين |
ثرومبوكسان A2 |
بروستاسيكلين I2 |
تشير التدخلات الدوائية في المرحلة الأولية من تكوين الخثرة في حالات الصدمة والعمليات الإقفارية الحادة في القلب والدماغ إلى الاحتمالية التالية:
- تثبيط التفاعلات الأولية (الكلي والجزئي) لسلسلة حمض الأراكيدونيك؛
- تثبيط تفاعل معين لتخليق الثرومبوكسان؛
- حصار مستقبلات الليكوترينات والثرومبوكسانات في الصفائح الدموية والعضلات الملساء والخلايا الأخرى؛
- استخدام المواد التي تعدل تراكم الصفائح الدموية، أي إضعاف رد فعل الأخيرة بطرق أخرى لتأثير العوامل المبدئية (الكولاجين، الثرومبوكسان A2، الليكوترينات، إلخ).
يُتيح تطبيق الطرق المذكورة لتصحيح اضطرابات الخواص الريولوجية للدم حل المهمة التكتيكية الرئيسية: حماية مستقبلات تجمع الصفائح الدموية والتصاقها من تأثير المنشطات، أو تثبيط الآليات الخلوية لتخليق هذه المستقبلات. ويمكن تثبيط التفاعلات الأولية لسلسلة حمض الأراكيدونيك من خلال حماية مستقبلات الصفائح الدموية التي تتفاعل مع المنشطات البوليمرية، باستخدام دكسترين منخفض الوزن الجزيئي، تتنافس جزيئاته مع الفيبرين والكولاجين والغلوبولين المناعي المتجمع (IgE) ومكونات نظام المتمم.
بإخفاء مستقبلات غشاء الصفائح الدموية والتنافس مع البروتينات واسعة الانتشار على سطح كريات الدم الحمراء، تُحل الدكسترينات منخفضة الوزن الجزيئي محلها وتُدمر الجسور بين الخلايا. ويرجع ذلك إلى أن الدكسترينات، التي تُغلف بطانة الأوعية الدموية وسطح عناصر خلايا الدم، تزيد من شحنتها السالبة، مما يُعزز خصائصها المضادة للتكتل.
ديكسترانس
يقلل دكسترين ذو الوزن الجزيئي المنخفض من تراكم الصفائح الدموية الناجم عن الكولاجين والأدينوزين ثنائي الفوسفات، فضلاً عن التأثير المنشط للثرومبين على الصفائح الدموية، ويمنع نمو خثرة الصفائح الدموية البيضاء الأولية، ويحسن تدفق الدم، ويقلل من الزيادة بعد الجراحة في محتوى الفيبرينوجين في البلازما، ويغير بنية واستقرار الفيبرين.
لا يقتصر دور حقن الدكسترين الوريدي في حالات الصدمة والرضوض على تقليل تراكم الصفائح الدموية والالتصاق بها، بل يُحفّز أيضًا الهيبارين الداخلي، مما يُعزز تكوين جلطة دموية رخوة يصعب انكماشها، والتي يسهل تحللها بواسطة مُحللات الفيبرين. يرتبط النشاط المضاد للثرومبين للدكسترين منخفض الوزن الجزيئي بتأثيره النوعي على بنية ووظيفة عامل تخثر الدم الثامن. العامل الثامن (الغلوبولين المضاد للهيموفيليا)، وهو جزيء كبير ذو بنية ووظيفة مُعقدة، يُشارك في تراكم الصفائح الدموية واستقرار الجلطة الناتجة. يتداخل الدكسترين مع عمل العامل الثامن، مما يُبطئ تراكم الصفائح الدموية ويُقلل من استقرار الجلطة.
إن الديكسترين منخفض الوزن الجزيئي ليس مضاد تخثر حقيقي، وتأثيره التصحيحي في اضطرابات الدورة الدموية يرتبط بشكل أساسي بتخفيف الدم وتجديد حجم البلازما المتداولة وتحسين تدفق الدم في نظام الدورة الدموية الدقيقة.
تُعزى قدرة الدكسترين على تحسين تدفق الدم في حالات اضطرابات الدورة الدموية (الصدمة، فقدان الدم) إلى مجموعة من العوامل. لا يؤدي وجود تركيز عالٍ مؤقت من البوليمر في الدم إلى "التخفيف المباشر للدم" فحسب، بل يُهيئ أيضًا ظروفًا لتدفق السوائل إلى مجرى الدم من الحيز الخلالي، وبالتالي موازنة التأثير التناضحي للدكسترين. ونتيجةً للتخفيف، تنخفض لزوجة الدم، ويزداد التدفق الوريدي إلى القلب، ويزداد النتاج القلبي. إلى جانب هذه التأثيرات، يُشكل الدكسترين مُركّبات مع الفيبرينوجين، ويكون له تأثير مُضاد لشحوم الدم.
وبالتالي، فإن التأثير المضاد للتكتل والتأثيرات الديناميكية الدموية للدكستروز منخفض الوزن الجزيئي يساعدان على تقليل لزوجة الدم، وهو أمر بالغ الأهمية عند انخفاض معدلات القص. يُحسّن تفكك خلايا الدم تدفق الدم الجهازي والدورة الدموية الدقيقة، وخاصةً في الجزء الوريدي، حيث تكون تدرجات السرعة في أدنى مستوياتها. يساعد استخدام محاليل الدكستروز منخفض الوزن الجزيئي في مختلف أنواع الصدمات، وأثناء العلاج الجراحي للإصابات وعواقبها، ثم في فترة ما بعد الجراحة، على الوقاية من فرط التخثر وتقليل احتمالية حدوث الخثار والانسداد الوريدي.
مع ذلك، تجدر الإشارة إلى أنه في بعض الحالات، قد تصاحب عمليات حقن محاليل الدكستران تفاعلات تأقية وتحسسية (خطيرة في حال وجود تحسس وصدمة تأقية). ويرجع ذلك إلى أن الدكستران، ذو الوزن الجزيئي الكبير والعديد من السلاسل الجانبية، يمكن أن يعمل كمستضد. لذلك، ولتحديد الحساسية الفردية، يُنصح بإعطاء ما يصل إلى 20 مل من محلول دكستران منخفض الوزن الجزيئي كهابتن (محلول 15%، وزن جزيئي 1000) عن طريق الوريد مسبقًا، وإجراء عمليات حقن بديل للبلازما قبل بدء التخدير.
 [ 9 ]، [ 10 ]، [ 11 ]، [ 12 ]، [ 13 ]، [ 14 ]، [ 15 ]، [ 16 ]، [ 17 ]، [ 18 ]
[ 9 ]، [ 10 ]، [ 11 ]، [ 12 ]، [ 13 ]، [ 14 ]، [ 15 ]، [ 16 ]، [ 17 ]، [ 18 ]
مثبطات الثرومبين
يمكن أيضًا تحقيق الحماية الدوائية لمستقبلات الصفائح الدموية المتفاعلة مع منشطات الصفائح الدموية باستخدام عوامل تتنافس مع منشطات الصفائح الدموية غير البوليمرية أو تثبطها. تشمل هذه العوامل مثبطات الثرومبين (الهيبارين والهيرودين، وعدد من المثبطات الاصطناعية، ومضادات الأدرينالين)، وحاصرات مستقبلات ألفا (فينتولامين، ثنائي هيدروإرغوتامين)، ومضادات ADP (ديبيريدامول، أدينوسين ونظائره البنيوية، فوسفوكرياتين)، ومضادات السيروتونين (ميثيسرجيد). يُستخدم عدد قليل فقط من العوامل المذكورة للوقاية من الصدمات النفسية وعلاجها من مصادر مختلفة.
من الممكن حماية الآليات داخل الخلايا لتخليق مستقبلات البروتين التي تتفاعل مع منشطات تجميع الصفائح الدموية والالتصاق، وتثبيط عمليات تخليق الثرومبوكسان باستخدام أدوية من مجموعات مختلفة:
- محفزات ومثبتات cATP، البروستاسيكلين والبروستاجلاندين PgE2؛
- مثبطات الفسفوليباز والفوسفوديستيراز.
بدأ التطوير المكثف لعوامل مضادة للصفيحات خاصة مؤخرًا نسبيًا، ولم يُسفر حتى الآن عن نتائج موثوقة. حاليًا، في الممارسة السريرية، بالإضافة إلى محاليل الدكسترين، تُستخدم على نطاق واسع عوامل مضادة للصفيحات مثل حمض أسيتيل الساليسيليك، وإندوميثاسين، وديبيرادامول، وسلفينبيرازون (بيرسانتين)، وبروستاسيكلين (إيكوبروستينون)، وهيبارين، لمنع تكوّن خثرات الصفيحات الدموية البيضاء.
الأدوية المضادة للالتهابات غير الستيرويدية
ثبت أن التأثيرات الدوائية لمضادات الالتهاب غير الستيرويدية - حمض أسيتيل الساليسيليك وإندوميثاسين - ترجع إلى تأثيرها على استقلاب الإيكوسانويدات (الثرومبوكسانات والبروستاجلاندينات). تُثبّط جميع أدوية هذه المجموعة تقريبًا مركب إنزيمي يُعرف باسم بروستاجلاندين سينثيتاز، مما يُظهر تأثيراتها النوعية والمضادة للتكتل.
يُمتص حمض أسيتيل الساليسيليك بسرعة كبيرة بعد تناوله عن طريق الفم. يُسبب حمض الساليسيليك، الناتج عن تحلله المائي، تثبيط إنزيم الأكسجين الحلقي للصفائح الدموية، مما يُعطل تحويل حمض الأراكيدونيك إلى بروستاغلاندين O2، وفي النهاية إلى ثرومبوكسان A2. يُثبط حمض أسيتيل الساليسيليك التكتل المُحفز بواسطة الكولاجين، وADP، والأدرينالين، والسيروتونين. على الرغم من أن مدة تأثيره GG0 5 تبلغ 15 دقيقة، إلا أن تأثيره المُضاد للتكتل يستمر لعدة أيام، وهو ما يُفسر على ما يبدو بالتثبيط غير القابل للعكس لتفاعلات تخليق البروستاغلاندين، وتثبيط وظيفة تكتل الصفائح الدموية طوال دورة حياتها (6-10 أيام). إلى جانب تثبيط إنزيم الأكسجين الحلقي للصفائح الدموية، يُثبط حمض أسيتيل الساليسيليك بجرعات عالية إنزيم الأكسجين الحلقي لجدار الأوعية الدموية، وفي الوقت نفسه، مع تثبيط تخليق ثرومبوكسان A2، يُثبط تخليق البروستاسيكلين في الخلايا البطانية. لذلك، ينبغي وصف حمض أسيتيل الساليسيليك كمضاد للتكتل بجرعات صغيرة (3000-5000 ملغ / يوم)، والتي تمنع بشكل أساسي تراكم الصفائح الدموية.
بما أن حمض الأسيتيل ساليسيليك يُثبط إنزيم الأكسجين الحلقي الصفيحي لعدة أيام، وإنزيم الأكسجين الحلقي البطاني لمدة لا تزيد عن يوم واحد، فمن المنطقي وصف الدواء كل 3-4 أيام، وليس يوميًا. يجب اختيار الجرعة المثلى من حمض الأسيتيل ساليسيليك لكل مريض على حدة، نظرًا لاختلاف حساسية المرضى لتأثير الدواء المضاد للصفيحات. في المرضى الذين يعانون من تفاعلات، يُثبط حمض الأسيتيل ساليسيليك بجرعة 0.5 غرام تراكم الصفائح الدموية بنسبة 40-50%، وفي المرضى الذين يعانون من فرط تفاعل، يُثبط تمامًا أو بنسبة 80-90%، أما المرضى الذين يعانون من تفاعلات شديدة، فيُعتبر غياب التأثير المضاد للصفيحات سمةً مميزةً عند تناول نفس الجرعة.
مثبطات إنزيم الثرومبوكسان سينثيتاز الانتقائية هي الإيميدازول ونظائره، والتي لا تُثبط إنزيم الأكسجين الحلقي. يُستخدم الديبيريدامول في الممارسة السريرية لعلاج أمراض القلب الإقفارية المزمنة كموسّع للشريان التاجي، وهو، مثل الإيميدازول، يُثبط إنزيم الثرومبوكسان سينثيتاز انتقائيًا، مما يمنع تخليق الثرومبوكسان A2. يُعتقد أن هذا الدواء ونظائره تُثبط أيضًا إنزيم فوسفودايستراز الصفائح الدموية، مما يزيد من تركيز cAMP في الصفائح الدموية. إلى جانب ذلك، يُثبط الديبيريدامول نشاط إنزيم أدينوسين دياميناز وامتصاص الأدينوزين بواسطة الصفائح الدموية، ويمنع امتصاص السيروتونين بواسطة الصفائح الدموية وتجمعها المُحفَّز بواسطة الأدرينالين والكولاجين. هناك تقارير عن ضعف نشاط الدواء كمضاد للصفيحات وقدرته على تعزيز تجمع الصفائح الدموية بجرعات صغيرة. يمكن تحقيق التأثير المضاد للصفيحات الأكثر موثوقية باستخدام مزيج من ديبيريدامول وحمض أسيتيل الساليسيليك.
الهيبارين
من بين العوامل المضادة للتخثر، يُعد الهيبارين أحد أكثر العوامل فعالية في تنظيم الحالة الكلية للدم، خاصةً عند استخدامه في المراحل المبكرة. يتميز الهيبارين بشحنة سالبة عالية، وهو قادر على التفاعل مع الأيونات والجزيئات الكبيرة والصغيرة (الإنزيمات، والهرمونات، والأمينات الحيوية، وبروتينات البلازما، إلخ)، لذا فإن نطاق تأثيره البيولوجي واسع جدًا. يتميز هذا الدواء بتأثيرات مضادة للثرومبين، ومضادة للثرومبوبلاستين، ومضادة للبروثرومبين، ويمنع تحويل الفيبرينوجين إلى فيبرين، ويكبح انكماش الجلطة، ويزيد من انحلال الفيبرين.
آلية عمل الهيبارين كمضاد للتخثر معقدة للغاية. وقد ثبت الآن أن تأثيرات الهيبارين المضادة للتخثر ترتبط بتعزيز عمل مضاد الثرومبين الثالث وتعزيز قدرة مركب الهيبارين-مضاد الثرومبين الثالث على تثبيط معظم إنزيمات السيرين بروتياز في نظام تخثر الدم بسرعة. وفي التأثير المضاد للتخثر للهيبارين، تُعد قدرته على زيادة الجهد الكهروسالبية العالي والحفاظ عليه في الطبقة الداخلية للأوعية الدموية، مما يمنع التصاق الصفائح الدموية وتكوين الجلطات الدموية الدقيقة، ذات أهمية بالغة. ويُثبط الهيبارين بشكل أكثر فعالية تكوين الجلطات في الأوردة، مما يمنع تكوين الجلطات الموضعية والتخثر المنتشر داخل الأوعية الدموية.
بروستاسيكلين ونظائره المستقرة
من بين مضادات الصفائح الدموية، يُعدّ البروستاسيكلين ونظائره المستقرة أقوى مثبطات التكتل. ويعود تأثير البروستاسيكلين المضاد للصفيحات إلى تحفيز إنزيم أدينيلات سيكليز، ما يؤدي إلى زيادة تركيز cAMP في الصفائح الدموية، وانخفاض محتوى الثرومبوكسان، وانخفاض محتوى الثرومبوكسان A2، وحصار مستقبلاته. البروستاسيكلين غير مستقر، ويتحلل بسرعة إلى نواتج غير فعالة، لذلك يُعطى عن طريق الوريد بالتنقيط بمعدل يتراوح بين 2 و20 نانوغرام/كغ في الدقيقة لمدة 30-60 دقيقة، حتى 6 مرات يوميًا.
يتمتع البروستاسيكلين، إلى جانب تأثيره القوي المضاد للتكتل، بتأثير قوي موسع للأوعية الدموية والشعب الهوائية. يُوسّع الدواء أوعية الدماغ والقلب والكلى والعضلات الهيكلية والأوعية المساريقية. تحت تأثير البروستاسيكلين، يزداد تدفق الدم التاجي، ويزداد إمداد عضلة القلب بالطاقة، وتنخفض حاجتها للأكسجين. على الرغم من عدم استقراره في الجسم، إلا أن آثاره السريرية الإيجابية قد تستمر لعدة أسابيع، بل وحتى أشهر. آلية هذا التأثير المطول غير واضحة بعد.
بروستاسيكلين دواء منخفض السمية، إلا أن استخدامه قد يُسبب آثارًا جانبية: احمرار الوجه، والصداع، وانخفاض ضغط الدم، وآلام البطن، وفقدان الشهية. إلى جانب بروستاسيكلين، تُعدّ نظائره الاصطناعية المستقرة (إيلوبروست، إلخ) مثبطات واعدة لتكتل الصفائح الدموية.
الأدوية التي تعمل على تحسين لزوجة الدم
لا تقتصر اضطرابات الخواص الريولوجية للدم أثناء الصدمات والرضوض على تغيرات النشاط الوظيفي للصفائح الدموية، بل تشمل أيضًا زيادة لزوجة الدم. وتتحدد اللزوجة الهيكلية للدم، كنظام ديناميكي معقد ومشتت، إلى حد كبير بلزوجة البلازما وقدرة كريات الدم الحمراء على التشوه. وتعتمد لزوجة البلازما بشكل رئيسي على تركيز البروتينات في الدم. فالبروتينات ذات الوزن الجزيئي الصغير، مثل الألبومين، لا تؤثر على لزوجة البلازما إلا قليلاً، بينما تزيدها البروتينات ذات الجزيئات الكبيرة (مثل الفيبرينوجين، وألفا وغاما غلوبولين، وجزيئات كبيرة أخرى) بشكل ملحوظ.
عند معدلات قص منخفضة، يؤدي امتزاز الفيبرينوجين والغلوبيولينات على سطح كريات الدم الحمراء إلى تكوين جسور بين الخلايا المجاورة وتكوين تكتلات منها. يُعدّ معدل تكوين التكتلات عملية بيوفيزيائية معقدة، ولا يعتمد فقط على شدة القص، بل يعتمد أيضًا على الخواص الحركية الكهربائية لكريات الدم الحمراء، وتركيز الجزيئات الكبيرة المُجمّعة وكتلتها وقدرتها على الامتصاص، بالإضافة إلى شكل كريات الدم الحمراء ومرونتها.
يتطلب الحفاظ على شكل غشاء كريات الدم الحمراء وخواصه الميكانيكية إنفاق طاقة كبيرة. يُعتقد أن الطاقة المُنتَجة في كريات الدم الحمراء أثناء تحلل الجلوكوز تُستَهدَف في فسفرة السبكترين، مما يُؤدي إلى تغيرات في البنية الثانوية للبروتين وتفاعله مع المكونات المجاورة للغشاء الداخلي. يلعب التفاعل بين البروتينين الهيكليين للغشاء، السبكترين والأكتين، دورًا هامًا في تكوين الخواص الميكانيكية لغشاء كريات الدم الحمراء، وفي الحفاظ على مساحة سطح ثابتة لكريات الدم الحمراء وسمكها تحت أي تشوه.
في حالة اضطرابات الدورة الدموية الجهازية وتدفق الدم في الأعضاء، يؤدي ازدياد صلابة أغشية كريات الدم الحمراء وتكوين تكتلات كريات الدم الحمراء إلى انخفاض معدل مرور كريات الدم الحمراء عبر الشعيرات الدموية، مما يُعطل وظيفة نقل الغازات في الدم. لذلك، ينبغي أن يشمل تصحيح اضطرابات الخواص الريولوجية للدم في حالات الصدمة، إلى جانب منع تكتل كريات الدم الحمراء، استعادة لزوجة البلازما والدم، وتكتل كريات الدم الحمراء وتشوهها.
بالإضافة إلى الدكستروز منخفض الوزن الجزيئي، تُعد محاليل الألبومين إحدى الوسائل الفعالة لزيادة استقرار تعليق الدم. في المرحلة المتأخرة من الصدمة، يحدث تراكم عام لكريات الدم الحمراء على خلفية انخفاض تركيز الألبومين في بلازما الدم وزيادة تركيز الفيبرينوجين والغلوبولينات، وخاصةً جزء ألفا 2، والبروتينات الدهنية، والدهون. في هذه الظروف، ترجع التأثيرات الريولوجية للألبومين إلى عاملين رئيسيين: تخفيف الدم وتطبيع نسبة البروتينات الكروية الدقيقة والكبيرة في البلازما. في الوقت نفسه، يرتبط الألبومين بالأحماض الحرة، التي يُحفز ترسبها أثناء الصدمة تراكم البنى الخلوية للدم والتخثر داخل الأوعية الدموية، وقد يُسبب الانسداد الدهني.
تُسهم التدابير المضادة للصدمة، التي تهدف إلى تجديد حجم الدم الدائر، والقضاء على نقص الأكسجين في الأنسجة والحماض الأيضي، في تطبيع مرونة أغشية كريات الدم الحمراء، إذ يُقلل نقص الأكسجين والحماض بشكل كبير من قابلية كريات الدم الحمراء للتشوه. ويُرجّح أن ترتبط زيادة صلابة أغشية كريات الدم الحمراء في حالة الصدمة بتثبيط تخليق ATP فيها. بدوره، يُسهم انخفاض تركيز ATP في زيادة تركيز Ca2+ في كريات الدم الحمراء، والذي بدوره، من خلال ارتباطه ببروتينات الغشاء، يزيد من صلابته.
من بين الأدوية الدوائية التي تزيد من محتوى ATP في كريات الدم الحمراء ومرونة أغشية كريات الدم الحمراء هو ترينتال (بنتوكسيفيلين)، والذي يستخدم في الممارسة السريرية لعلاج الاضطرابات الإقفارية.
بالإضافة إلى تقليل صلابة أغشية كريات الدم الحمراء، يسبب ترينتال توسع الأوعية الدموية، ويحسن أكسجة الأنسجة، ويمنع نشاط فوسفوديستيراز في الأنسجة، ويزيد من تركيز cAMP ويمنع تراكم الصفائح الدموية.
ومن بين العوامل الدوائية الأخرى التي تحافظ على مرونة غشاء كريات الدم الحمراء، تجدر الإشارة إلى مضادات Ca2+، التي تحد من تدفق الأيونات إلى كريات الدم الحمراء (فلوناريزين، نيفيديبين، إلخ).
 [ 19 ]، [ 20 ]، [ 21 ]، [ 22 ]، [ 23 ]، [ 24 ]، [ 25 ]، [ 26 ]، [ 27 ]
[ 19 ]، [ 20 ]، [ 21 ]، [ 22 ]، [ 23 ]، [ 24 ]، [ 25 ]، [ 26 ]، [ 27 ]
انتباه!
لتبسيط مفهوم المعلومات ، يتم ترجمة هذه التعليمات لاستخدام العقار "العقاقير التي تمنع تجلط الدم وتحسن من انسيابية الدم" وتقديمه بشكل خاص على أساس الإرشادات الرسمية للاستخدام الطبي للدواء. قبل الاستخدام اقرأ التعليق التوضيحي الذي جاء مباشرة إلى الدواء.
الوصف المقدم لأغراض إعلامية وليست دليلًا للشفاء الذاتي. يتم تحديد الحاجة إلى هذا الدواء ، والغرض من نظام العلاج ، وأساليب وجرعة من المخدرات فقط من قبل الطبيب المعالج. التطبيب الذاتي خطر على صحتك.

