
تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
الغدد الجار درقية
خبير طبي في المقال
آخر مراجعة: 04.07.2025

في عام ١٨٧٩، وصف العالم السويدي س. ساندستروم الغدد جارات الدرقية لدى البشر وأطلق عليها اسمًا. الغدد جارات الدرقية أعضاء حيوية، وظيفتها إنتاج وإفراز هرمون جارات الدرقية (PTH)، وهو أحد أهم منظمات أيض الكالسيوم والفوسفور.
الغدة جار الدرقية العلوية (الغدة جار الدرقية العلوية) والغدة جار الدرقية السفلية (الغدة جار الدرقية السفلية) هما جسمان دائريان أو بيضاويان يقعان على السطح الخلفي لكل فص من فصي الغدة الدرقية: غدة في الأعلى والأخرى في الأسفل. يتراوح طول كل غدة بين 4 و8 مم، وعرضها بين 3 و4 مم، وسمكها بين 2 و3 مم. عدد هذه الغدد غير ثابت، ويمكن أن يتراوح بين 2 و7 و8 غدد، ويبلغ متوسط عددها أربع غدد. يبلغ متوسط الوزن الإجمالي للغدد 1.18 جم.
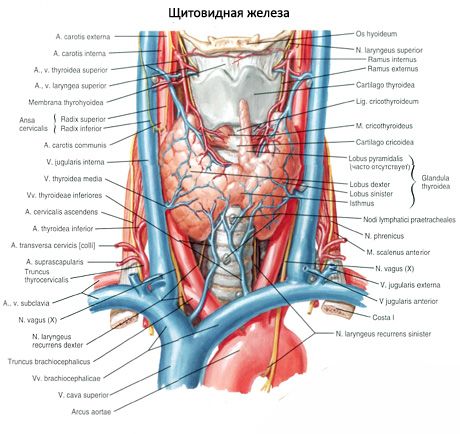
تختلف الغدد جارات الدرقية عن الغدة الدرقية بلونها الفاتح (عند الأطفال تكون وردية باهتة، وعند البالغين بنية مائلة للصفرة). غالبًا ما تقع الغدد جارات الدرقية في موقع اختراق أنسجة الغدة الدرقية عن طريق الشرايين الدرقية السفلية أو فروعها. تنفصل الغدد جارات الدرقية عن الأنسجة المحيطة بها بواسطة محفظتها الليفية، والتي تمتد منها طبقات النسيج الضام إلى الغدد. تحتوي هذه الأخيرة على عدد كبير من الأوعية الدموية، وتقسم الغدد جارات الدرقية إلى مجموعات من الخلايا الظهارية.
يتكون نسيج الغدد من الخلايا الجار درقية الرئيسية والمحبة للحمض، والتي تُشكل حبالاً وعناقيد محاطة بحزم رقيقة من ألياف النسيج الضام. يُعتبر كلا النوعين من الخلايا مراحل مختلفة من نمو الخلايا الجار درقية. تتميز الخلايا الجار درقية الرئيسية بشكلها متعدد السطوح، وسيتوبلازمها قاعدي، وتحتوي على عدد كبير من الريبوسومات. من بين هذه الخلايا، تتميز الخلايا الداكنة (التي تُفرز بنشاط) والخلايا الفاتحة (الأقل نشاطًا). تتميز الخلايا الجار درقية المحبة للحمض بأنها كبيرة، ذات خطوط واضحة، وتحتوي على العديد من الميتوكوندريا الصغيرة مع جزيئات الجليكوجين.
هرمون الغدة جار الدرقية، الباراثيروكسين (هرمون الغدة جار الدرقية)، هو بروتين في تركيبه، ويشارك في تنظيم أيض الفوسفور والكالسيوم. يقلل هرمون الغدة جار الدرقية من إفراز الكالسيوم في البول، ويزيد امتصاصه في الأمعاء بوجود فيتامين د. أما الثيروكالسيتونين فهو مضاد لهرمون الغدة جار الدرقية.
التكوين الجنيني للغدد جارات الدرقية
تنمو الغدد جارات الدرقية من ظهارة الجيوب الخيشومية المزدوجة الثالثة والرابعة. في الأسبوع السابع من النمو، تنفصل الظهارة الأساسية للأجسام عن جدران الجيوب الخيشومية، وتتحرك خلال عملية النمو نحو الذيل. بعد ذلك، تستقر الغدد جارات الدرقية المتكونة بشكل دائم على السطحين الخلفيين للفصين الأيمن والأيسر للغدة الدرقية.
 [ 7 ]، [ 8 ]، [ 9 ]، [ 10 ]، [ 11 ]، [ 12 ]
[ 7 ]، [ 8 ]، [ 9 ]، [ 10 ]، [ 11 ]، [ 12 ]
أوعية وأعصاب الغدد جارات الدرقية
يتم إمداد الغدد جارات الدرقية بالدم من خلال فروع الشريان الدرقي العلوي والسفلي، بالإضافة إلى فرعي المريء والقصبة الهوائية. يتدفق الدم الوريدي عبر الأوردة التي تحمل الاسم نفسه. يشبه تعصيب الغدد جارات الدرقية تعصيب الغدة الدرقية.
السمات المرتبطة بالعمر للغدد جارات الدرقية
يتراوح إجمالي كتلة الغدد جارات الدرقية لدى حديثي الولادة بين 6 و9 ملغ. خلال السنة الأولى من العمر، تزداد كتلتها الكلية 3-4 مرات، وبحلول سن الخامسة تتضاعف مرة أخرى، وبحلول سن العاشرة تتضاعف ثلاث مرات. بعد 20 عامًا، يصل إجمالي كتلة الغدد جارات الدرقية الأربع إلى 120-140 ملغ، ويبقى ثابتًا حتى الشيخوخة. في جميع الأعمار، تكون كتلة الغدد جارات الدرقية لدى النساء أكبر بقليل منها لدى الرجال.
عادةً ما يكون لدى الشخص زوجان من الغدد جارات الدرقية (العلوية والسفلية)، وتقع على السطح الخلفي للغدة الدرقية، خارج كبسولتها، بالقرب من القطبين العلوي والسفلي. ومع ذلك، يمكن أن يختلف عدد الغدد جارات الدرقية وموقعها؛ في بعض الأحيان يتم العثور على ما يصل إلى 12 غدة جارات الدرقية. يمكن أن توجد في أنسجة الغدة الدرقية والغدة الزعترية، في المنصف الأمامي والخلفي، في التامور، خلف المريء، في منطقة تشعب الشريان السباتي. الغدد جارات الدرقية العلوية لها شكل بيضاوي مسطح، والغدد جارات الدرقية السفلية كروية. أبعادها تتراوح تقريبًا من 6x3 إلى 4x1.5 - 3 مم، والوزن الإجمالي من 0.05 إلى 0.5 جم، واللون أحمر أو بني مصفر. يتم إمداد الغدد جارات الدرقية بالدم بشكل رئيسي عن طريق فروع الشريان الدرقي السفلي، ويحدث التدفق الوريدي عبر أوردة الغدة الدرقية والمريء والقصبة الهوائية. تُعصب الغدد جارات الدرقية بالألياف الودية للعصبين الحنجريين الراجع والعلوي، بينما يُعصبها العصب المبهم بالألياف اللاودية. تُغطى الغدد جارات الدرقية بكبسولة رقيقة من النسيج الضام؛ وتخترق الحواجز الممتدة منها الغدد. تحتوي على أوعية دموية وألياف عصبية. يتكون نسيج الغدد جارات الدرقية من الخلايا جارات الدرقية، أو الخلايا الرئيسية، والتي تتميز، وفقًا لدرجة التلوين، بالخلايا الفاتحة أو اللامعة النشطة هرمونيًا، بالإضافة إلى الخلايا الداكنة الساكنة. تُشكل الخلايا الرئيسية مجموعات وحبالًا وعناقيد، وفي كبار السن - بصيلات ذات غرواني في التجويف. لدى البالغين، تظهر خلايا، تقع بشكل رئيسي على طول محيط الغدد جارات الدرقية، مصبوغة بصبغة الإيوزين - خلايا يوزينية أو محبة للأكسجين، وهي خلايا رئيسية متحللة. في الغدد جارات الدرقية، يمكن أيضًا العثور على أشكال انتقالية بين الخلايا الرئيسية والخلايا المحبة للأكسجين.
تم تحقيق النجاحات الأولى في توضيح قضايا التخليق وفك تشفير البنية ودراسة استقلاب هرمون الغدة جار الدرقية بعد عام 1972. هرمون الغدة جار الدرقية هو بولي ببتيد أحادي السلسلة يتكون من 84 بقايا حمض أميني، خالٍ من السيستين، بوزن جزيئي يبلغ حوالي 9500 دالتون، يتكون في الغدد جار الدرقية من مادة حيوية سابقة - هرمون الغدة جار الدرقية (proPTH)، والذي يحتوي على 6 أحماض أمينية إضافية في الطرف NH 2. يتم تصنيع ProPTH في الخلايا الرئيسية للغدد جار الدرقية (في شبكتها الإندوبلازمية الحبيبية) وفي عملية الانقسام البروتيني في جهاز جولجي يتحول إلى هرمون الغدة جار الدرقية. نشاطه البيولوجي أقل بكثير من نشاط PTH. يبدو أن proPTH غائب في دم الأشخاص الأصحاء، ولكن في الحالات المرضية (مع وجود ورم غدي في الغدد جار الدرقية) يمكن أن يفرز في الدم مع PTH. مؤخرًا، اكتُشفت مادة سابقة لهرمون الغدة النخامية الظهارية (proPTH)، وهي preproPTH، تحتوي على 25 بقايا حمض أميني إضافية عند الطرف الطرفي NH2. وبالتالي، يحتوي preproPTH على 115 بقايا حمض أميني، وproPTH - 90، وPTH - 84.
تم الآن تحديد بنية هرمون الغدة جار الدرقية البقري والخنزيري بشكل كامل. تم عزل هرمون الغدة جار الدرقية البشري من أورام الغدة جار الدرقية، ولكن لم يتم فك رموز بنيته إلا جزئيًا. هناك اختلافات في بنية هرمون الغدة جار الدرقية، ولكن هرمونات الغدة جار الدرقية الحيوانية والبشرية تُظهر تفاعلًا مناعيًا متصالبًا. يحتفظ البوليببتيد المكون من بقايا الأحماض الأمينية الـ 34 الأولى عمليًا بالنشاط البيولوجي للهرمون الطبيعي. يسمح لنا هذا بافتراض أن النسبة المتبقية تقريبًا من الجزيء عند الطرف الكربوكسيلي لا ترتبط ارتباطًا مباشرًا بالتأثيرات الرئيسية لهرمون الغدة جار الدرقية. يُظهر الجزء 1-29 من هرمون الغدة جار الدرقية أيضًا نشاطًا بيولوجيًا ومناعيًا معينًا. يُظهر الجزء غير النشط بيولوجيًا 53-84 أيضًا تأثيرًا مناعيًا، أي أن خصائص هرمون الغدة جار الدرقية هذه تظهر في قسمين على الأقل من جزيئه.
هرمون الغدة جار الدرقية المتداول في الدم غير متجانس، ويختلف عن الهرمون الأصلي الذي تفرزه الغدد جار الدرقية. يُميز الدم ثلاثة أنواع على الأقل من هرمون الغدة جار الدرقية: هرمون الغدة جار الدرقية السليم بوزن جزيئي 9500 دالتون؛ مواد غير نشطة بيولوجيًا من الجزء الكربوكسيلي من جزيء هرمون الغدة جار الدرقية بوزن جزيئي يتراوح بين 7000 و7500 دالتون؛ ومواد نشطة بيولوجيًا بوزن جزيئي يبلغ حوالي 4000 دالتون.
تم العثور على شظايا أصغر في الدم الوريدي، مما يشير إلى أنها تشكلت على المحيط. كانت الأعضاء الرئيسية التي تشكلت فيها شظايا هرمون الغدة جار الدرقية هي الكبد والكلى. زاد تجزئة هرمون الغدة جار الدرقية في هذه الأعضاء في أمراض الكبد والفشل الكلوي المزمن (CRF). في ظل هذه الظروف، بقيت شظايا هرمون الغدة جار الدرقية في مجرى الدم لفترة أطول بكثير من الأفراد الأصحاء. امتص الكبد هرمون الغدة جار الدرقية سليمًا بشكل أساسي، لكنه لم يزيل شظايا هرمون الغدة جار الدرقية الطرفية الكربوكسيلية أو الطرفية الأمينية من الدم. لعبت الكلى دورًا رائدًا في استقلاب هرمون الغدة جار الدرقية. لقد شكلت ما يقرب من 60٪ من التصفية الأيضية للهرمون المناعي التفاعلي الطرفي الكربوكسيلي و 45٪ من الشظية الأمينية الطرفية لهرمون الغدة جار الدرقية. كانت المنطقة الرئيسية لاستقلاب الشظية الأمينية الطرفية النشطة لهرمون الغدة جار الدرقية هي العظام.
تم رصد إفراز نابض لهرمون الغدة جار الدرقية، يكون في أشد حالاته ليلًا. بعد 3-4 ساعات من بداية النوم الليلي، يكون محتواه في الدم أعلى بمقدار 2.5-3 مرات من متوسط مستواه خلال النهار.
الوظيفة الرئيسية لهرمون الغدة جار الدرقية هي الحفاظ على توازن الكالسيوم. وفي الوقت نفسه، يُعدّ الكالسيوم في المصل (الكلي وخاصةً المتأين) المنظم الرئيسي لإفراز هرمون الغدة جار الدرقية (انخفاض مستويات الكالسيوم يُحفّز إفرازه، بينما تُثبّطه زيادته)، أي أن التنظيم يتم وفقًا لمبدأ التغذية الراجعة. في حالات نقص كالسيوم الدم، يزداد تحويل هرمون الغدة جار الدرقية إلى هرمون الغدة جار الدرقية. كما يلعب محتوى المغنيسيوم في الدم دورًا مهمًا في إفراز هرمون الغدة جار الدرقية (ارتفاع مستواه يُحفّز إفرازه، بينما يُثبّطه انخفاضه). الأهداف الرئيسية لهرمون الغدة جار الدرقية هي الكلى والعظام الهيكلية، ولكن تأثيره على امتصاص الكالسيوم في الأمعاء، وتحمل الكربوهيدرات، ومستويات الدهون في المصل، ودوره في تطور العجز الجنسي، وحكة الجلد، وما إلى ذلك، معروف.
لتوصيف تأثير هرمون الغدة جار الدرقية على العظام، من الضروري تقديم معلومات موجزة عن بنية أنسجة العظام، وخصائص امتصاصها وإعادة تشكيلها الفسيولوجي.
من المعروف أن معظم الكالسيوم في الجسم (حتى 99%) يوجد في أنسجة العظام. ولأنه يوجد في العظام على شكل مركبات الفوسفور والكالسيوم، فإن نسبة 1% من إجمالي محتوى الفوسفور توجد أيضًا في العظام. ورغم طبيعتها الثابتة الظاهرية، إلا أن أنسجتها تخضع لعملية إعادة تشكيل مستمرة، وتنتشر فيها الأوعية الدموية بنشاط، وتتميز بخصائص ميكانيكية عالية. تُعد العظام "مستودعًا" ديناميكيًا للفوسفور والمغنيسيوم ومركبات أخرى ضرورية للحفاظ على التوازن الداخلي في عملية التمثيل الغذائي للمعادن. يتضمن تركيبها مكونات معدنية كثيفة ترتبط ارتباطًا وثيقًا بالمصفوفة العضوية، التي تتكون من 90-95% من الكولاجين، وكميات صغيرة من عديدات السكاريد المخاطية، وبروتينات غير كولاجينية. يتكون الجزء المعدني من العظام من هيدروكسي أباتيت - صيغته التجريبية هي Ca10 (PO4) 6 (OH) 2 - وفوسفات الكالسيوم غير المتبلور.
يتكون العظم من خلايا بانيات العظم، التي تنشأ من خلايا اللحمة المتوسطة غير المتمايزة. وهي خلايا وحيدة النواة تشارك في تركيب مكونات مصفوفة العظم العضوية. تقع في طبقة أحادية على سطح العظم، وهي على تماس وثيق مع النسيج العظمي. تتولى خلايا بانيات العظم مسؤولية ترسب النسيج العظمي وتمعدنه اللاحق. ناتج نشاطها الحيوي هو الفوسفاتاز القلوي، الذي يُعدّ محتواه في الدم مؤشرًا غير مباشر على نشاطها. محاطة بالنسيج العظمي المتمعدن، تتحول بعض خلايا بانيات العظم إلى خلايا عظمية - خلايا وحيدة النواة، يُشكّل سيتوبلازمها قنوات متصلة بقنوات الخلايا العظمية المجاورة. لا تشارك هذه الخلايا في إعادة تشكيل العظم، ولكنها تشارك في عملية التدمير حول العظم، وهو أمر مهم للتنظيم السريع لمستويات الكالسيوم في مصل الدم. تتم عملية ارتشاف العظم بواسطة الخلايا الناقضة للعظم - خلايا عملاقة متعددة النوى، تتشكل على ما يبدو من اندماج البلاعم وحيدة النواة. يُفترض أيضًا أن أسلاف الخلايا الناقضة للعظم قد تكون خلايا جذعية مكونة للدم من نخاع العظم. إنها متحركة، وتشكل طبقة متصلة بالعظم، وتقع في مناطق امتصاصه الأكبر. بسبب إطلاق الإنزيمات المحللة للبروتين والفوسفاتاز الحمضي، تسبب الخلايا الناقضة للعظم تحلل الكولاجين، وتدمير هيدروكسيباتيت، وإزالة المعادن من المصفوفة. أنسجة العظام حديثة التكوين ضعيفة التمعدن (العظمية) مقاومة لامتصاص الخلايا الناقضة للعظم. وظائف الخلايا البانية للعظم والخلايا الناقضة للعظم مستقلة، ولكنها منسقة مع بعضها البعض، مما يؤدي إلى إعادة تشكيل الهيكل العظمي بشكل طبيعي. يعتمد نمو العظام في الطول على التعظم الغضروفي، بينما يعتمد نمو العرض والسمك على التعظم السمحاقي. أظهرت الدراسات السريرية باستخدام الكالسيوم 47 أن ما يصل إلى 18٪ من إجمالي محتوى الكالسيوم في الهيكل العظمي يتجدد كل عام. عندما تتضرر العظام (كسور، عمليات معدية)، يتم إعادة امتصاص العظم المتغير وتشكيل عظم جديد.
تُسمى المجمعات الخلوية المشاركة في عملية ارتشاف وتكوين العظام المحلية بوحدات إعادة البناء متعددة الخلايا الأساسية (BMUs). وهي تُنظم التركيز المحلي للكالسيوم والفوسفور وأيونات أخرى، وتخليق المكونات العضوية للعظام، وخاصة الكولاجين، وتنظيمها وتمعدنها.
يتمثل التأثير الرئيسي لهرمون الغدة جار الدرقية في عظام الهيكل العظمي في تعزيز عمليات الامتصاص، مما يؤثر على كل من المكونات المعدنية والعضوية لبنية العظام. يعزز هرمون الغدة جار الدرقية نمو الخلايا الناقضة للعظم ونشاطها، ويصاحب ذلك تأثير مُحسِّن لتحلل العظم وزيادة في امتصاصه. في هذه الحالة، تذوب بلورات هيدروكسي أباتيت مع إطلاق الكالسيوم والفوسفور في الدم. تُعد هذه العملية الآلية الرئيسية لزيادة مستوى الكالسيوم في الدم. تتكون من ثلاثة مكونات: تعبئة الكالسيوم من العظم حول الفك السفلي (الخلايا العظمية العميقة)؛ تكاثر الخلايا السلفية للعظم إلى الخلايا الناقضة للعظم؛ الحفاظ على مستوى ثابت من الكالسيوم في الدم من خلال تنظيم إطلاقه من العظم (الخلايا العظمية السطحية).
وهكذا، يزيد هرمون الغدة جار الدرقية في البداية من نشاط الخلايا العظمية والخلايا الناقضة للعظم، مما يعزز انحلال العظم، مما يسبب زيادة في مستوى الكالسيوم في الدم وزيادة إفراز الكالسيوم والأوكسيبرولين في البول. هذا هو التأثير النوعي والسريع الأول لهرمون الغدة جار الدرقية. أما التأثير الثاني لهرمون الغدة جار الدرقية على العظام فهو كمي. ويرتبط بزيادة في تجمع الخلايا الناقضة للعظم. مع انحلال العظم النشط، يحدث حافز لزيادة تكاثر الخلايا العظمية، ويتم تنشيط كل من الامتصاص وتكوين العظام مع غلبة الامتصاص. مع زيادة هرمون الغدة جار الدرقية، يحدث توازن عظمي سلبي. ويصاحب ذلك إفراز مفرط للأوكسيبرولين - وهو نتاج تحلل الكولاجين وأحماض السياليك المدرجة في بنية عديدات السكاريد المخاطية. ينشط هرمون الغدة جار الدرقية أحادي فوسفات الأدينوزين الحلقي (cAMP). يمكن أن يكون زيادة إفراز cAMP في البول بعد تناول هرمون الغدة جار الدرقية بمثابة مؤشر على حساسية الأنسجة له.
إن أهم تأثير لهرمون الغدة جار الدرقية على الكلى هو قدرته على تقليل إعادة امتصاص الفوسفور، مما يزيد من بيلة الفوسفات. تختلف آلية التخفيض في أجزاء مختلفة من النيفرون: في الجزء القريب، يرجع هذا التأثير لهرمون الغدة جار الدرقية إلى زيادة النفاذية ويحدث بمشاركة cAMP، بينما في الجزء البعيد، لا يعتمد على cAMP. يتغير التأثير الفوسفاتي لهرمون الغدة جار الدرقية مع نقص فيتامين د، والحماض الأيضي، وانخفاض محتوى الفوسفور. تزيد هرمونات الغدة جار الدرقية بشكل طفيف من إعادة الامتصاص الأنبوبي الكلي للكالسيوم. في الوقت نفسه، فإنها تقلله في الأجزاء القريبة وتزيده في الأجزاء البعيدة. وهذا الأخير له أهمية كبيرة - هرمون الغدة جار الدرقية يقلل من تصفية الكالسيوم. يقلل هرمون الغدة جار الدرقية من إعادة الامتصاص الأنبوبي للصوديوم وبيكربوناته، مما قد يفسر تطور الحماض في فرط نشاط الغدة جار الدرقية. يزيد من تكوين 1,25-دايوكسي كوليكالسيفيرول 1,25(OH 2 )D 3 في الكلى، وهو الشكل النشط لفيتامين د 3. يزيد هذا المركب من إعادة امتصاص الكالسيوم في الأمعاء الدقيقة عن طريق تحفيز نشاط بروتين محدد مرتبط بالكالسيوم (CaBP) في جدارها.
يتراوح متوسط المستوى الطبيعي لهرمون الغدة جار الدرقية بين 0.15 و0.6 نانوغرام/مل. ويختلف باختلاف العمر والجنس. يبلغ متوسط محتوى هرمون الغدة جار الدرقية في دم الأشخاص الذين تتراوح أعمارهم بين 20 و29 عامًا (0.245 ± 0.017) نانوغرام/مل، وفي الفئة العمرية 80-89 عامًا (0.545 ± 0.048) نانوغرام/مل؛ ويبلغ مستوى هرمون الغدة جار الدرقية لدى النساء في سن السبعين (0.728 ± 0.051) نانوغرام/مل، ولدى الرجال في نفس العمر (0.466 ± 0.40) نانوغرام/مل. وبالتالي، يزداد محتوى هرمون الغدة جار الدرقية مع التقدم في السن، ولكن بدرجة أكبر لدى النساء.
وكقاعدة عامة، ينبغي استخدام عدة اختبارات مختلفة للتشخيص التفريقي لفرط كالسيوم الدم.
نقدم التصنيف السريري والمرضي الذي قمنا بتطويره، استنادًا إلى تصنيف OV Nikolaev و VN Tarkaeva (1974).
التصنيف السريري والمرضي للأمراض المرتبطة بضعف إفراز هرمون الغدة جار الدرقية والحساسية له
فرط نشاط الغدة جار الدرقية الأولي
- حسب المرض:
- أورام غدية مفرطة الوظائف؛
- فرط تنسج العضلة العاصرة الشرجية؛
- سرطان الغدة جار الدرقية المفرط الوظيفة؛
- الأورام الصماوية المتعددة من النوع الأول مع فرط نشاط الغدة جار الدرقية (متلازمة فيرمر)؛
- ورم صماء متعدد من النوع الثاني مع فرط نشاط الغدة جار الدرقية (متلازمة سيبل).
- وفقا للخصائص السريرية:
- شكل العظم:
- هشاشة العظام،
- التهاب العظم الكيسي الليفي،
- "باجيتويد"؛
- الشكل الحشوي:
- مع أضرار سائدة في الكلى والجهاز الهضمي والمجال العصبي والنفسي؛
- شكل مختلط.
- شكل العظم:
- المصب:
- حار؛
- مزمن.
فرط نشاط الغدة جار الدرقية الثانوي (فرط نشاط الغدة جار الدرقية الثانوي وفرط تنسج الغدد جار الدرقية مع نقص كالسيوم الدم وفرط فوسفات الدم لفترة طويلة)
- أمراض الكلى:
- الفشل الكلوي المزمن؛
- اعتلال الأنابيب (نوع ألبرايت-فانكوني)؛
- الكساح الكلوي.
- أمراض الأمعاء:
- متلازمة سوء الامتصاص.
- أمراض العظام:
- لين العظام الشيخوخي؛
- النفاس؛
- مجهول السبب؛
- مرض باجيت.
- نقص فيتامين د:
- مرض كلوي؛
- الكبد؛
- نقص الأنزيمات الوراثي.
- الأمراض الخبيثة: المايلوما.
فرط نشاط الغدة جار الدرقية الثالثي
- ورم غدي يعمل بشكل مستقل في الغدد جارات الدرقية، ويتطور على خلفية فرط نشاط جارات الدرقية الثانوي طويل الأمد.
فرط نشاط الغدة جار الدرقية الكاذب
- إنتاج هرمون الغدة جار الدرقية بواسطة الأورام ذات المنشأ غير جار الدرقية.
التكوينات الكيسية والورمية غير النشطة هرمونيًا في الغدد جارات الدرقية
- كيس.
- الأورام غير النشطة هرمونيًا أو السرطان.
قصور الغدة جار الدرقية
- نقص خلقي في نمو الغدد جارات الدرقية أو غيابها.
- أصل مجهول السبب، مناعي ذاتي.
- ما بعد الجراحة، تم تطويره بالتزامن مع إزالة الغدد جارات الدرقية.
- بعد العملية الجراحية بسبب ضعف إمداد الدم والتغذية العصبية.
- الأضرار الإشعاعية الخارجية والداخلية (العلاج الإشعاعي الخارجي، علاج مرض الغدة الدرقية باليود المشع).
- تلف الغدد جارات الدرقية نتيجة النزيف أو الاحتشاء.
- الآفات المعدية.
قصور الغدة جار الدرقية الكاذب
- النوع الأول - عدم حساسية الأعضاء المستهدفة لهرمون الغدة جار الدرقية، ويعتمد على أدينيلات سيكليز؛
- النوع الثاني - عدم حساسية الأعضاء المستهدفة لهرمون الغدة جار الدرقية، بغض النظر عن أدينيلات سيكليز، وربما يكون من أصل المناعة الذاتية.
قصور الغدة جارة الدرقية الكاذب
وجود علامات جسدية لقصور الغدة جار الدرقية الكاذب لدى الأقارب الأصحاء في عائلات المرضى المصابين بقصور الغدة جار الدرقية الكاذب دون اضطرابات كيميائية حيوية مميزة ودون تكزز.
 [ 13 ]، [ 14 ]، [ 15 ]، [ 16 ]، [ 17 ]، [ 18 ]، [ 19 ]، [ 20 ]، [ 21 ]
[ 13 ]، [ 14 ]، [ 15 ]، [ 16 ]، [ 17 ]، [ 18 ]، [ 19 ]، [ 20 ]، [ 21 ]
Использованная литература

