منشورات جديدة
مشتقات مركبات الثاليدومايد تؤدي إلى موت الخلايا السرطانية المقاومة
آخر مراجعة: 02.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
تشير دراسة أجرتها جامعة جوته في فرانكفورت إلى إمكانية استخدام مشتقات الثاليدوميد لعلاج السرطان. كان الثاليدوميد يُباع كحبوب منومة في خمسينيات القرن الماضي، ثم اشتهر لاحقًا بتسببه في تشوهات خلقية خطيرة في المراحل الأولى من الحمل.
يُعرف هذا الجزيء أيضًا بقدرته على تحديد البروتينات في الخلية لتدميرها. وفي إطار الدراسة الحالية، ابتكر العلماء مشتقات من الثاليدوميد. وتمكنوا من إثبات أن هذه المواد تؤثر على تدمير البروتينات المسؤولة عن بقاء الخلايا السرطانية.
ربما لم يشهد أي جزيء آخر ماضٍ مضطرب مثل الثاليدوميد. كان المكون الرئيسي لدواء مُعتمد في العديد من الدول في خمسينيات القرن الماضي كمهدئ ومنوم. ولكن سرعان ما اتضح أن النساء الحوامل اللواتي يتناولن الثاليدوميد غالبًا ما يلدن أطفالًا بتشوهات خطيرة.
ومع ذلك، في العقود الأخيرة، عاود الطبّ تعليق آمال كبيرة عليه. فقد أظهرت الدراسات، من بين أمور أخرى، أنه يثبط نمو الأوعية الدموية، وبالتالي يُحتمل أن يكون مناسبًا لفصل الأورام عن بيئتها المغذية. كما أثبت فعاليته الكبيرة في علاج الورم النقوي المتعدد، وهو أورام خبيثة في نخاع العظم.
يوضح الدكتور شينغلاي تشنغ من معهد الكيمياء الصيدلانية بجامعة جوته في فرانكفورت: "نعلم الآن أن الثاليدوميد يُمكن أن يُسمى "غراءً جزيئيًا". هذا يعني أنه قادر على التقاط بروتينين وربطهما معًا".
وهذا مثير للاهتمام بشكل خاص لأن أحد هذه البروتينات هو نوع من "آلات الوسم": فهو يربط علامة "قمامة" واضحة ببروتين آخر.
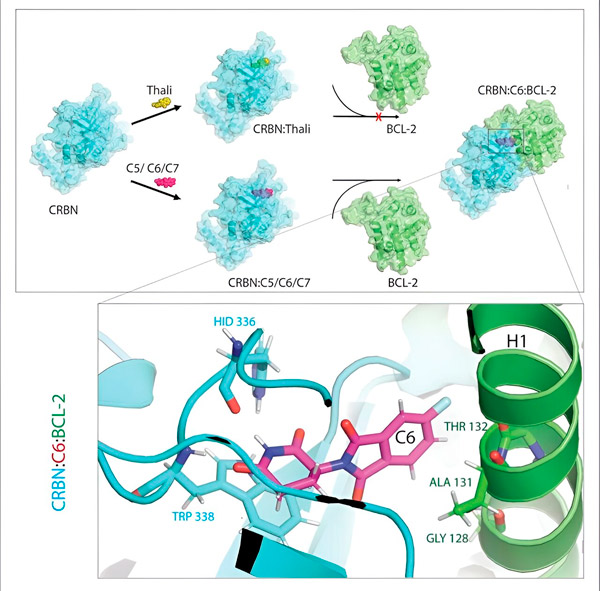
تُغيّر مشتقات الثاليدوميد C5 وC6 وC7 بروتين CRBN، "آلة الوسم"، ليتمكن من الارتباط ببروتين BCL-2. بهذه الطريقة، يُعَدّ جزيء BCL-2 مُعَلَّمًا للتحلل، وهي استراتيجية جديدة محتملة لمكافحة السرطان. المؤلف: د. شينغلاي تشنغ.
يتعرف نظام التخلص من الفضلات في الخلية على هذه العلامة: فيلتقط جزيء البروتين المُوسوم ويمزقه. يقول تشنغ: "تفسر هذه الآلية التأثيرات المختلفة للثاليدوميد. فبحسب البروتين المُوسوم، يمكن أن يُسبب تشوهات أثناء النمو الجنيني أو يُدمر الخلايا الخبيثة".
تفتح هذه الآلية آفاقًا واسعة في الطب، إذ تعتمد خلايا السرطان على بروتينات معينة للبقاء على قيد الحياة. لو أمكن استهدافها وتقطيعها بشكل منهجي، لربما أمكن علاج المرض. لكن المشكلة تكمن في أن هذا الغراء الجزيئي غريبٌ جدًا.
أحد شركاء الارتباط دائمًا هو آلة وسم الخلية، أو كما يُسمى علميًا، رابط E3 يُسمى CRBN. قليلٌ جدًا من بين آلاف البروتينات في الجسم يُمكن أن يكون الشريك الثاني، ويعتمد اختياره على الصمغ.
يقول تشنغ: "لذلك، أنشأنا سلسلة من مشتقات الثاليدوميد. ثم اختبرنا ما إذا كانت لها خصائص التصاق، وإذا كانت كذلك، فأي البروتينات كانت فعالة ضدها". لتحقيق ذلك، أضاف الباحثون مشتقاتهم إلى جميع البروتينات في سلالة الخلايا المزروعة. ثم لاحظوا أي هذه البروتينات تحللت بعد ذلك في وجود CRBN.
خلال هذه العملية، حددنا ثلاثة مشتقات يمكنها وسم بروتين خلوي مهم جدًا لعملية التحلل، وهو بروتين BCL-2، يوضح تشنغ. "يمنع بروتين BCL-2 الخلايا من تفعيل برنامج التدمير الذاتي، فإذا لم يكن موجودًا، تموت الخلايا."
لهذا السبب، لطالما كان بروتين BCL-2 محورًا لأبحاث السرطان. حتى أن هناك دواءً لعلاج سرطان الدم يُسمى فينيتوكلاتس، يُقلل من فعالية BCL-2، وبالتالي يُسبب تدمير الخلايا المتحولة ذاتيًا.
ومع ذلك، في العديد من خلايا السرطان، يكون بروتين BCL-2 نفسه متحورًا. ونتيجةً لذلك، لم يعد فينيتوكلاتكس يثبط هذا البروتين، كما يقول تشنغ. "لقد تمكنا من إثبات أن مشتقاتنا تُشير أيضًا إلى هذا الشكل المتحور للتحلل. بالإضافة إلى ذلك، قام شركاؤنا في معهد ماكس بلانك للفيزياء الحيوية بمحاكاة تفاعل مشتقات الثاليدوميد مع BCL-2 على جهاز حاسوب. وقد أظهر هذا أن المشتقات ترتبط بمواقع مختلفة تمامًا عن فينيتوكلاتكس - وهي نتيجة تمكنا لاحقًا من تأكيدها تجريبيًا."
اختبر الباحثون أيضًا مركباتهم على ذباب الفاكهة المُصاب بخلايا سرطانية. وكان معدل نجاة الذباب المُعالج بهذه الطريقة أعلى بكثير. ومع ذلك، يُحذّر تشنغ من المبالغة في الآمال، إذ لا تزال هذه النتائج مجرد أبحاث أولية. "مع أنها تُظهر أن جزيئات الثاليدوميد المُعدّلة تتمتع بإمكانيات علاجية كبيرة، إلا أننا لا نستطيع الجزم بعدُ ما إذا كانت ستُثبت فعاليتها عمليًا في مرحلة ما."
ونشرت نتائج الدراسة في مجلة Cell Reports Physical Science.
