منشورات جديدة
تؤكد الدراسة على الحاجة إلى علاجات خاصة بنوع الخلايا لفيروس نقص المناعة البشرية
آخر مراجعة: 02.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
أثبت باحثون في جامعة إلينوي أهمية استهداف أنواع محددة من الخلايا في علاج فيروس نقص المناعة البشرية. وتُعدّ دراستهم، المنشورة في مجلة وقائع الأكاديمية الوطنية للعلوم ، من أوائل الدراسات التي تبحث في التأثيرات التفاضلية أو الخاصة بنوع الخلية لتعديل زمن انتقال فيروس نقص المناعة البشرية على الخلايا النخاعية، وهي نوع من الخلايا المناعية يُنتج في نخاع العظم.
من أهم العوائق أمام القضاء على عدوى فيروس نقص المناعة البشرية إدارة فترة الخمول، وهي الفترة التي تبقى فيها الخلية المصابة خاملة وغير قادرة على إنتاج الفيروس. تتجمع خلايا فيروس نقص المناعة البشرية الكامنة في الجسم في أماكن تُعرف باسم المستودعات. تُشكل المستودعات الكامنة مشكلة لأنها قد تبدأ بإنتاج الفيروس في أي وقت.
يتطلب القضاء التام على المرض إزالة جميع الخلايا الكامنة من الجسم أو مقاومة دائمة لمحفزات التنشيط. ومع ذلك، يمكن أن تُحفّز عوامل متعددة إعادة التنشيط، بما في ذلك الإشارات التي تُوجّه تمايز الخلايا النخاعية.
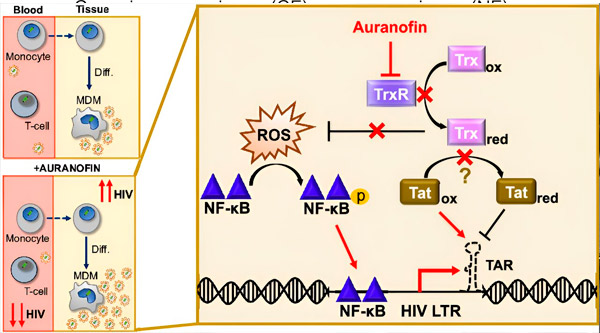
قد يُشكّل تنظيم فترة تأخر فيروس نقص المناعة البشرية في الخلايا البلعمية المشتقة من الخلايا الوحيدة (MDMs) خطرًا على انتشار الفيروس. يُمكن أن يُحفّز تمايز الخلايا الوحيدة إلى خلايا بلعمية إعادة تنشيط فيروس نقص المناعة البشرية، مما قد يُعزز انتشار الفيروس في الأنسجة (أعلى اليسار). يُقلّل دواءٌ سريريٌّ مُرشّح، وهو أورانوفين، من الحمض النووي الفيروسي في الدم ويُعزز فترة تأخر فيروس نقص المناعة البشرية في الخلايا التائية والخلايا الوحيدة، ولكنه يُسبب إعادة تنشيط فيروس نقص المناعة البشرية في الخلايا البلعمية المشتقة من الخلايا الوحيدة (أسفل اليسار). في الخلايا البلعمية المشتقة من الخلايا الوحيدة، نفترض أن تثبيط أورانوفين لمستقبلات TrxR يؤدي إلى تراكم أنواع الأكسجين التفاعلية (ROS)، مما يُحفّز تنشيط NF-κB وتنشيط مُحفّز LTR لفيروس نقص المناعة البشرية (يمين). يُقلّل تثبيط مستقبلات TrxR من اختزال الركيزة، مما يسمح لبروتين Tat بالبقاء مُؤكسدًا بشكلٍ تفضيلي، حيث يُمكنه الارتباط بـ TAR وبدء نسخ فيروس نقص المناعة البشرية. المصدر: وقائع الأكاديمية الوطنية للعلوم (2024). DOI: 10.1073/pnas.2313823121
لسنوات، ركزت أبحاث علاج فيروس نقص المناعة البشرية على نهجين يُعرفان باسم "الصدمة والقتل" و"الحجب والقفل". يعمل الأول بالتزامن مع العلاج المضاد للفيروسات القهقرية لتنشيط الخلايا المصابة الكامنة والقضاء عليها من خلال عملية موت الخلايا المبرمج، بينما يُجبر الثاني الخلايا المصابة على الدخول في حالة كامنة عميقة لا تستطيع إعادة تنشيطها من تلقاء نفسها.
ركزت الأبحاث المتعلقة بهذه التقنيات تقليديًا على نوع من خلايا الدم البيضاء يُسمى الخلايا التائية، وهي الهدف الرئيسي لعدوى فيروس نقص المناعة البشرية. ومع ذلك، فإن المستودعات الكامنة لا تتكون فقط من الخلايا التائية؛ بل تحتوي في الواقع على عشرات الأنواع المختلفة من الخلايا، ولكل منها أنماط فريدة من التعبير الجيني لفيروس نقص المناعة البشرية.
قال كولين كيفر، الأستاذ المساعد في علم الأحياء الدقيقة ومؤلف الدراسة: "هناك تنوع هائل في الخلايا، حتى ضمن السلالة الواحدة. ويزداد تباين الاستجابة في هذه المستودعات مع كل نوع جديد من الخلايا".
أرادت ألكسندرا بلانكو، طالبة الدراسات العليا في مختبر كيفر، دراسة أنواع الخلايا التي أغفلتها أبحاث فيروس نقص المناعة البشرية التقليدية. بالتركيز على الخلايا النخاعية، أنشأت مكتبة استنساخ تحتوي على 70 مجموعة من الخلايا الوحيدة المصابة بشكل كامن. ثم حللت بلانكو المجموعات الاستنساخية واستجاباتها للتنشيط. تباينت الاستجابات بشكل كبير، مما يُبرز التنوع الكبير داخل نوع الخلية الواحد.
أثارت هذه الملاحظة سؤالاً جديداً: هل تختلف استجابة أنواع الخلايا المختلفة لعلاجات تأخر ظهور فيروس نقص المناعة البشرية؟ في الواقع، أظهرت نتائجهم أن بعض علاجات تأخر ظهور فيروس نقص المناعة البشرية يمكن أن تعزز تأخر ظهور الفيروس في الخلايا التائية والوحيدات، بينما يمكنها عكس تأخر ظهور الفيروس في الخلايا البلعمية.
قال كيفر: "ليست جميع خلايا الجسم متشابهة. لذا، من المنطقي ألا تستجيب جميع الخلايا المصابة للفيروس بنفس الطريقة".
وتسلط ورقتهم البحثية الضوء على الحاجة إلى أن تأخذ علاجات فيروس نقص المناعة البشرية المستقبلية في الاعتبار جميع أنواع الخلايا وكيف قد تستجيب كل خلية للعلاجات المحتملة.
وتستند نتائجهم إلى أبحاث أجراها روي دار، أستاذ الهندسة الحيوية السابق في ولاية إلينوي، والذي درس مختبره التباين في التعبير الجيني لفيروس نقص المناعة البشرية.
قال كيفر: "بدأ هو المشروع، ثم تولينا زمام الأمور وطوّرناه حتى وصل إلى ما هو عليه اليوم. وهكذا، ساهم هذا التعاون في تحقيق هذه النتائج. لقد فتح هذا المجال أمام مختبرنا، ونحن متحمسون جدًا له".
كشفت نتيجة إضافية غير متوقعة من تحليل بلانكو عن تغيرات في حجم الخلايا وشكلها استجابةً للعدوى، مما يشير إلى أن فيروس نقص المناعة البشرية (HIV) يمكن أن يغير مورفولوجيا الخلايا. يهدف بلانكو التالي إلى تحديد الآليات البيولوجية الكامنة وراء هذه التغيرات الظاهرية.
يتطلع كيفر وأعضاء مختبره أيضًا إلى إعادة إنتاج نتائجهم، التي أُجريت في الغالب على سلالة خلوية، في الخلايا الأولية. وأوضح كيفر أن إعادة إنتاج النتائج في نموذج أقرب إلى الإنسان من شأنه أن يُحسّن الأهمية السريرية للدراسة.
قال بلانكو: "نرغب في إجراء فحوصات أوسع نطاقًا على الخلايا التائية والوحيدات والبلعميات لتحديد الأدوية المحتملة التي قد تعمل على جميع أنواع الخلايا هذه. قد نكتشف جزيئات أكثر لا تتصرف بطريقة محددة لنوع الخلية".
