
تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
نهج جديد يمنع تكيف الخلايا السرطانية ويضاعف فعالية العلاج الكيميائي
آخر مراجعة: 27.07.2025
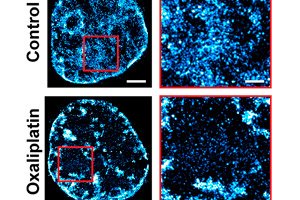
في نهج جديد تمامًا لعلاج السرطان، نجح مهندسو الطب الحيوي من جامعة نورث وسترن في مضاعفة فعالية العلاج الكيميائي في تجربة على الحيوانات.
بدلاً من مهاجمة السرطان مباشرةً، تمنع هذه الاستراتيجية الفريدة خلايا السرطان من التطور لتصبح مقاومة للعلاجات، مما يجعل المرض أكثر عرضة للأدوية الحالية. لم يقتصر هذا النهج على القضاء على المرض تقريبًا في مزارع الخلايا، بل حسّن أيضًا فعالية العلاج الكيميائي بشكل ملحوظ في نماذج الفئران المصابة بسرطان المبيض.
ونشرت الدراسة في مجلة وقائع الأكاديمية الوطنية للعلوم.
يقول فاديم باكمان، من جامعة نورث وسترن، والذي قاد الدراسة: "الخلايا السرطانية متكيفة بشكل ممتاز. فهي قادرة على التكيف مع أي شيء تقريبًا. أولًا، تتعلم كيفية التهرب من الجهاز المناعي. ثم تتعلم كيفية مقاومة العلاج الكيميائي والعلاج المناعي والإشعاعي. وعندما تصبح مقاومة لهذه العلاجات، تعيش لفترة أطول وتكتسب طفرات جديدة. لم نكن نريد القضاء على الخلايا السرطانية مباشرةً، بل أردنا أن نسلبها قوتها الخارقة - قدرتها الفطرية على التكيف والتغيير والتهرب".
باكمان هو أستاذ عائلة ساكس للهندسة الطبية الحيوية والطب في كلية ماكورميك للهندسة بجامعة نورث وسترن، حيث يُدير مركز الجينوم والهندسة الفيزيائية. وهو أيضًا عضو في مركز روبرت هـ. لوري الشامل للسرطان، ومعهد كيمياء العمليات الحيوية، والمعهد الدولي لعلوم النانو.
الكروماتين هو مفتاح البقاء على قيد الحياة من السرطان
للسرطان سمات مميزة عديدة، لكن سمة واحدة تكمن وراءها جميعًا: قدرته الدائمة على البقاء. حتى عندما يهاجم الجهاز المناعي والعلاجات الطبية المكثفة الورم، قد ينكمش السرطان أو يتباطأ نموه، لكنه نادرًا ما يختفي تمامًا. على الرغم من أن الطفرات الجينية تساهم في المقاومة، إلا أن حدوثها بطيء جدًا بحيث لا يُفسر الاستجابة السريعة لخلايا السرطان للإجهاد.
في سلسلة من الدراسات، اكتشف فريق باكمان آليةً أساسيةً تفسر هذه القدرة. فالتنظيم المعقد للمادة الوراثية، المعروفة باسم الكروماتين، يُحدد قدرة السرطان على التكيف والصمود حتى مع أقوى الأدوية.
الكروماتين، وهو مجموعة من الجزيئات الكبيرة التي تشمل الحمض النووي الريبوزي منقوص الأكسجين (DNA) والحمض النووي الريبوزي منقوص الأكسجين (RNA) والبروتينات، يُحدد الجينات المكبوتة وتلك التي تُعبَّر عنها. ولتجميع مترين من الحمض النووي (DNA) اللذين يُشكِّلان الجينوم في مساحة لا تتجاوز جزءًا من مئة من المليمتر داخل نواة الخلية، يكون الكروماتين شديد الكثافة.
ومن خلال الجمع بين التصوير والنمذجة وتحليل الأنظمة والتجارب الحية، وجد فريق باكمان أن البنية ثلاثية الأبعاد لهذه الحزمة لا تتحكم فقط في الجينات التي يتم تنشيطها وكيفية استجابة الخلايا للإجهاد، بل تسمح أيضًا للخلايا بترميز "ذاكرة" لأنماط نسخ الجينات فعليًا في هندسة الحزمة نفسها.
يعمل الترتيب ثلاثي الأبعاد للجينوم كنظام تعلم ذاتي، يشبه خوارزمية التعلم الآلي. وأثناء عملية التعلم، يُعاد تنظيم هذا الترتيب باستمرار إلى آلاف من نطاقات الكروماتين النانوية. يخزن كل نطاق جزءًا من الذاكرة النسخية للخلية، والتي تُحدد كيفية عملها.
إعادة برمجة الكروماتين لتعزيز العلاج الكيميائي
في الدراسة الجديدة، طوّر باكمان وزملاؤه نموذجًا حاسوبيًا يستخدم مبادئ فيزيائية لتحليل كيفية تأثير تراكم الكروماتين على احتمالية نجاة الخلايا السرطانية من العلاج الكيميائي. بتطبيق النموذج على أنواع مختلفة من الخلايا السرطانية وفئات مختلفة من أدوية العلاج الكيميائي، وجد الفريق أنه قادر على التنبؤ بدقة بنجاة الخلايا، حتى قبل بدء العلاج.
لأن تغليف الكروماتين ضروري لبقاء الخلايا السرطانية، تساءل العلماء: ماذا سيحدث لو تغيّرت بنية التغليف؟ بدلاً من ابتكار أدوية جديدة، قاموا بفحص مئات الأدوية الموجودة لإيجاد أدوية مرشحة يمكنها تعديل البيئة الفيزيائية داخل نواة الخلية والتأثير على تغليف الكروماتين.
وفي نهاية المطاف، اختار الفريق عقار سيليكوكسيب، وهو دواء مضاد للالتهابات معتمد من إدارة الغذاء والدواء الأمريكية ويُستخدم بالفعل لعلاج التهاب المفاصل وأمراض القلب والأوعية الدموية، والذي يعمل كأثر جانبي على تغيير تعبئة الكروماتين.
النتائج التجريبية
وبدمج السيليكوكسيب مع العلاج الكيميائي القياسي، لاحظ الباحثون زيادة كبيرة في عدد الخلايا السرطانية التي ماتت.
في نماذج الفئران لسرطان المبيض، أدى الجمع بين عقار باكليتاكسيل (دواء شائع في العلاج الكيميائي) وسيليكوكسيب إلى تقليل معدل تكيف الخلايا السرطانية وتحسين قمع نمو الورم، متفوقًا على تأثير عقار باكليتاكسيل وحده.
عندما استخدمنا جرعة منخفضة من العلاج الكيميائي، استمرت الأورام في النمو. ولكن بمجرد إضافة مُنظِّم اللدونة النسخية (TPR) المُرشَّح إلى العلاج الكيميائي، لاحظنا تثبيطًا أكبر بكثير للنمو، مما ضاعف الفعالية، كما قال باكمان.
الآفاق المحتملة
قد تُمكّن هذه الاستراتيجية الأطباء من استخدام جرعات أقل من العلاج الكيميائي، مما يُقلل من الآثار الجانبية الشديدة. وهذا من شأنه أن يُحسّن راحة المرضى وتجربتهم في علاج السرطان بشكل ملحوظ.
ويعتقد باكمان أن إعادة برمجة الكروماتين قد تكون مفتاحاً لعلاج أمراض معقدة أخرى، بما في ذلك أمراض القلب والأوعية الدموية والأمراض العصبية التنكسية.
