
تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
السرطان مرض متعدد العوامل
آخر مراجعة: 01.07.2025
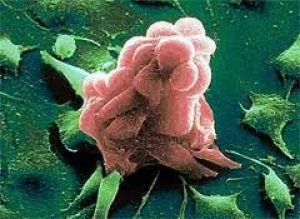
قدّم علماء من معهد البحوث الطبية الحيوية في برشلونة (إسبانيا)، بقيادة ترافيس ستاكر وزملائه من مركز سلون كيترينج للسرطان في نيويورك (الولايات المتحدة الأمريكية)، معلومات جديدة حول أصل الأورام الخبيثة. ونُشرت نتائج دراستهم في مجلة وقائع الأكاديمية الوطنية للعلوم (مفتوحة المصدر).
يشير المؤلفون إلى أن الظهور الأولي للورم، ونوعه، ومدى عدوانيته، يعتمد على مجموعة محددة من العيوب في عدة عمليات تهدف إلى الحفاظ على سلامة الخلايا، مثل مسارات إصلاح الحمض النووي أو التحكم في دورة الخلية. وكدليل على ذلك، أظهروا أن الفئران التي تعاني من درجة عالية من عدم الاستقرار الكروموسومي وخلل في برنامج موت الخلايا المبرمج (موت الخلايا المبرمج) - وهما أبرز "العلامات السوداء" للسرطان - نادرًا ما تُصاب بالسرطان.
وفقًا للباحثين، يعتمد تكوّن الورم من عدمه، أولًا، على لحظة حدوث الضرر خلال دورة الخلية، وثانيًا، على أيٍّ من مكونات نظام الإصلاح قد تضرر، وأخيرًا، على أيٍّ من مكونات نظام التدمير الذاتي الأخرى قد ضعفت في هذه اللحظة. أي أن الأهم ليس عاملًا واحدًا، ولا عطلًا واحدًا (يسهل اكتشافه لاحقًا)، بل مزيج مؤسف من عدة عوامل وعيوب في آنٍ واحد.
استخدم مؤلفو الدراسة فئرانًا تحمل طفرات في جينات رئيسية مسؤولة عن استعادة الحمض النووي التالف. ثم دمجوا هذه الجينات مع طفرات أخرى أثرت إما على مسار موت الخلايا المبرمج أو على جودة التحكم في دورة الخلية، حتى اكتشفوا ذلك المزيج "غير الموفق" للفئران، والذي كانت مجموعة عوامله كافية لبدء عملية التسرطن.
أثناء تضاعف الحمض النووي، تحتوي الخلية المنقسمة على سلسلة من نقاط التفتيش التي تختبر صحة عملية التضاعف. إذا اكتشفت الخلية أخطاءً في أي نقطة، يتوقف نموها وتبدأ عملية إصلاح الحمض النووي المعقدة للغاية. إذا كان هذا الخلل هو الآخر وتراكمت المزيد من الأخطاء في الجينوم، تدخل بروتينات خط الدفاع الأخير، مثل بروتين p53 الكابت للورم، حيز التنفيذ. وبدون إضاعة الوقت على تفاصيل تافهة، تبدأ هذه البروتينات فورًا في تنشيط برنامج موت الخلية أو مقاطعة دورة الخلية (ستكبر الخلية وتموت دون أن تترك أي ذرية). كل هذا، كما ترون، عبارة عن شبكة معقدة للغاية من البروتينات المتفاعلة.
أظهرت الدراسة أن عدم الاستقرار الجينومي بحد ذاته ليس شرطًا ضروريًا وكافٍ لتطور الورم بالضرورة. ويعتقد الباحثون ضرورة دراسة أنواع مختلفة من الأورام الخبيثة بتفصيل أكبر، ومحاولة تحديد العوامل الرئيسية المسببة لنشوء الورم، حتى وإن كان ذلك أصعب من البحث عن إبرة في كومة قش، لأن عاملًا واحدًا واضحًا، كما اتضح الآن، لا يكفي.
إن التعرف الدقيق على مكونات "التركيبات غير المحظوظة" قد يحدث ثورة في التشخيص والعلاج الحديث للسرطان.

 [
[